La catálisis enzimática de las reacciones es esencial para
los sistemas vivos. En condiciones biológicas, las reacciones no catalizadas
tienden a ser lentas. La mayoría de moléculas biológicas son muy estables en
las condiciones de pH neutro, temperatura suave y ambiente acuoso suave y
ambiente acuoso presentes en el interior de las células.
Muchos procesos químicos comunes son desfavorables o poco
probables en el ambiente célula, tales como la formación transitoria de
intermediarios cargados inestables o la colisión de dos o más moléculas con la
orientación precisa requerida para la reacción. En pocas palabras, las
reacciones necesarias para digerir los alimentos, enviar señales nerviosas o
contraer el musculo no se dan a una velocidad útil sin catálisis.
Un enzima soluciona estos problemas al proporcionar un
ambiente específico dentro del cual una
reacción determinada puede transcurrir a mayor velocidad. El rasgo distintivo
de una reacción catalizada enzimáticamente es que tiene lugar dentro de los
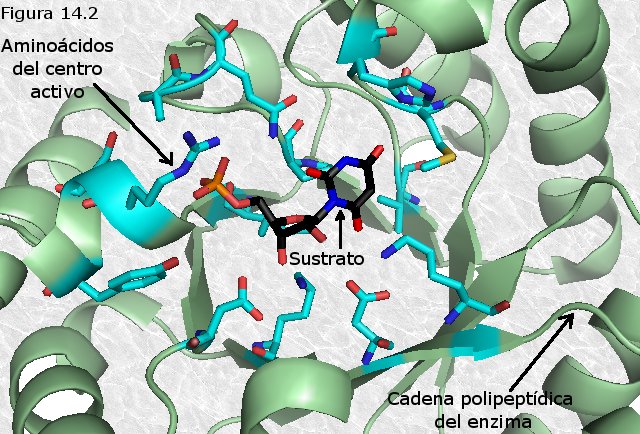
confines de una bolsa de la enzima denominada sitio activo. La molécula fija en el sitio activo y sobre la que
actúa el enzima se denomina sustrato. La
superficie activo del enzima esta revestida con residuos aminoácidos con grupos
sustituyentes que se unen al sustrato y catalizan su formación química. A menudo, el sitio activo recubre el sustrato y
lo secuestra completamente con la disolución el complejo enzima-sustrato, cuya
existencia fue propuesta por primera vez por Charles-Adolphe Wurtz en 1880, es
de importancia central en la acción de los enzimas. Es también el punto de
partida de los tratamientos matemáticos que definen el comportamiento cinético
de las reacciones catalizadas por enzimas, así como las descripciones teóricas
de los mecanismos enzimáticos.
 |
| FIG.1. Fijación de un sustrato al sitio activo de un enzima. |
La función de los enzimas y de otros catalizadores consiste
en hacer disminuir la energía de activación, ∆G+*, de una reacción para
incrementar su velocidad de reacción. El equilibrio de una reacción no se ve
afectado por el enzima.
LAS VELOCIDADES DE REACCIONES Y LOS EQUILIBRIOS TIENEN DEFINICIONES
TERMODINÁMICAS PRECISAS
Los equilibrios de reacción están unidos inextricablemente a
la variación de energía libre estándar de la reacción, ∆G’°,
mientras que las velocidades de reacción están unidas a las reacciones de
activación, ∆G*. Una introducción básica a estas relaciones termodinámicas
constituye el próximo paso para saber cómo funcionan los enzimas.
Un equilibrio tal
como S ⇌ P viene descrito por una constante de equilibrio, Keq’ o simplemente K (p. 24) en
las condiciones estándar utilizadas para comprar los procesos bioquímicos, una
constante de equilibrio se denota por K’eq (o K’):
Keq=
___[p]___
[s]
Partiendo de la termodinámica, puede
describirse la relación entre una K’eq y ∆G’° mediante la
Expresión:
∆G’° = RTInK’Eq
Donde R es la constante de los gases
(8,315 J/mol·K) y T es la temperatura absoluta 298 K (25°C). Aquí el punto
importante es que la contante de equilibrio está relacionada directamente con
el cambio de energía libre estándar global de la reacción (TABLA 1). Un valor negativo grande de ∆G’° refleja un
equilibrio de reacción favorable, aunque esto no significa que la reacción
transcurra a una
velocidad elevada.
K’eq
|
∆G’° (KJ/mol)
|
10-6
|
34,2
|
10-5
|
28,5
|
10-4
|
22,8
|
10-3
|
17,1
|
10-2
|
11,4
|
10-1
|
5,7
|
1
|
0,0
|
101
|
-5,7
|
102
|
-11,4
|
103
|
-17,1
|
FIG. 1 Relación entre K’eq y ∆G’°
La velocidad de una reacción viene
determinada por la concentración de reactivo (o reactivos) y por una constante de velocidad generalmente
representada por el símbolo K. para la reacción unmolecular S→ P, la velocidad de la reacción, V, que
representa la cantidad de S que a reaccionado por unidad de tiempo viene
expresada por una ecuación de velocidad
V=
R(S)
En esta reacción la velocidad solo
depende de la concentración de S. Es lo que se denomina una reacción de primer
orden. El factor K es una constante de proporcionalidad que refleja la
probabilidad de reacción bajo un conductor de condiciones (PH, temperatura,
etc.). Aquí, K es una constante de velocidad de primer orden y sus unidades son
tiempos inversos. Si una reacción de primer orden tiene una constante de
velocidad K de 0,03 s-1 se puede interpretar (cualitativamente) que
3% de sustrato asequible será convertido en P en 1s. Una reacción con una
constante de velocidad de 2.333s-1 estará lista en una pequeña
fracción de segundo. Si una velocidad reacción depende de la concentración de
dos compuesto diferentes, o si reaccionan dos moléculas del mismo compuesto, la
reacción es de segundo orden y K es una constante de velocidad de segundo orden
(con unidades M-1 S -1). La ecuación de la velocidad
tiene entonces la formula
V=R [S1] [S2]
Aplicando la teoría del estado de
transición se puede deducir una expresión que relaciona la magnitud de la
constante de velocidad con la energía de activación:
R=
e-∆G*/RT
Donde K es la constante de Boltzmann y h
es la constante de Planck. El punto importante es que esta relación entre la
constante de velocidad K y la energía de activación, ∆G/, es inversa y
exponencial. En forma simplificada está en la base de la afirmación de que una
energía de activación menor significa una velocidad de reacción mayor.
UNOS POCOS PRINCIPIOS EXPLICAN EL PODER CATALÍTICO Y LA ESPECIFICIDAD DE LOS ENZIMAS
Los enzimas son catalizadores
extraordinarios. Los aumentos de velocidad conseguidos por los enzimas son de 5
a 17 órdenes de magnitud (TABLA 2). Los enzimas también son muy específicos,
discriminado fácilmente entre sustratos con estructuras muy similares.
Ciclofilina
|
105
|
Carbónico anhidrasa
|
107
|
Triosa fosfato isomerasa
|
109
|
Carboxipeptidasa A
|
1011
|
Fosfoglucomutasa
|
1012
|
Succinil-CoA transferasa
|
1013
|
Ureasa
|
1014
|
Oritidina monofosfato descarboxilasa
|
1017
|
TABLA. 2 Algunos incrementos de velocidad
producidos por los enzimas.
Entre los sustratos y grupos funcionales
de los enzimas (cadenas laterales específicas de aminoácidos, iones metálicos y
coenzimas) tienen lugar reacciones químicas de muchos tipos.
Los grupos funcionales catalíticos de los
enzimas pueden formar enlaces covalentes transitorios de un sustrato,
activándolo para la reacción, o bien puede transferirse transitoriamente un
grupo del sustrato al enzima. En muchos casos, estas reacciones solo tienen
lugar en el sitio activo del enzima. Las interacciones covalentes entre enzimas
y sustratos hacen disminuir la energía de activación (por lo que acelera la
reacción), proporcionando un camino de reacción alternativa y de menor energía.
Gran parte de la energía requerida para
disminuir la energía de activación procede generalmente de interacciones
débiles no covalentes entre sustrato y el enzima. El factor que diferencia
realmente a los enzimas de la mayoría de catalizadores no enzimáticos es la
función de un complejo especifico la interacción entre enzimas y sustrato en
este complejo esta medida por la misma fuerza que estabiliza la estructura
proteica, entre ellas fuentes de hidrógeno e interacciones iónicas e
hidrofobias. El establecimiento de cada interacción débil en el complejo ES
viene acompañado por la liberación de una pequeña cantidad de energía libre que
estabiliza la interacción lamina energía
de fijación, ∆GB.
Su significado se extiende más de una simple
estabilización de la interacción enzima-sustrato. La energía de fijación es la
principal fuente de energía libre
utilizada por los enzimas para disminuir la energía de activación de las
reacciones.
Hay dos principios fundamentales que esta
interrelacionados y que proporcionan una explicación general de como los
enzimas aprovechan la energía de unión no covalente.
1. La mayor parte del poder catalítico de
los enzimas proceden de un último término de la energía libre liberada al
formarse los múltiples enlaces débiles e interacciones entre una enzima y su
sustrato. Esta energía de fijación contribuye tanto a la especificidad como a
la catálisis.
2. Las interacciones débiles están optimizadas
en el estado de transición de la reacción; los sitios activos de los enzimas
son complementarios no a los sustratos, sino a los estados de transición a
través de los que pasan los sustratos al ser convertidos en productos durante
una reacción.
LA ENERGÍA DE FIJACIÓN CONTRIBUYE A LA
ESPECIFICIDAD DE REACCIÓN Y A LAS CATÁLISIS
La misma energía de fijación que aporta energía
para la catálisis también hace que el enzima sea específico. La especificidad se refiere a la capacidad de un enzima de discriminar
entre un sustrato y una molécula competitiva. Conceptualmente, las
especificidades fáciles de distinguir de la catálisis. No obstante, la catálisis y la especificidad son mucho más difíciles de diferenciar
experimentalmente por surgen del mismo fenómeno si el sitio activo de un enzima
tiene grupos funcionales ordenados de manera óptima para formar una serie de
interacciones débiles con un sustrato determinado en el estado de transición,
el; enzima no podrá interaccionar también con ningún otro sustrato. por
ejemplo, si el sustrato tiene un grupo hidroxilo que forma un puente de
hidrogeno especifico con un residuo Glu del enzima cualquier molécula que
carezca de este grupo hidroxilo concreto será en general, un peor sustrato para
el enzima, además, cualquier molécula con un grupo funcional extra para que
el enzima no contiene un bolsa o sitio
de fijación será muy probablemente excluida del enzima en general, la especificidad
proviene de la formación de múltiples interacciones débiles entre el enzima, y
su molécula del sustrato especifica.
Es posible demostrar la importancia de la
energía de fijación en la catálisis. Por ejemplo, el enzima glacolítico triosa
fosfato isomerasa cataliza la interconversion entre el gliceraldehído 3-fosfato
y la dihidroxiacetona fosfato.
Entre los factores físicos y
termodinámicos principales que contribuyen al valor ∆G*, la barrera para una
reacción se podría incluir: (1) la entropía (libertad de movimiento) de las
moléculas en disolución, que reduce la posibilidad de que reaccionen entre
ellas; (2) la capa de solvatación del agua unida por puentes de hidrógeno que
rodea y ayuda a estabilizar muchas biomoleculas en disolución acuosa; (3) la distorsión de los sustratos que han de
tener lugar en muchas reacciones, (4) la necesidad de conseguir un alineamiento
adecuado de los grupos funcionales catalíticos en el enzima. Se puede utilizar
la energía de fijación para superar todas estas barreras.
En primer lugar, una gran restricción en
los movimientos relativos de los dos sustratos que han de reaccionar o reducción de entropía, es uno de los
beneficios obvios de su fijación al enzima. La energía de fijación mantiene los
sustratos en la orientación correcta para reaccionar, lo que es una
contribución muy importante a la catálisis ya que las colisiones reductivas
entre moléculas en disolución puede ser extremadamente raras. Los sustratos se
pueden alinear sobre el enzima de forma precisa, generando un gran número de
interacciones débiles entre ellos y grupos localizados de manera estratégica en
el enzima, lo que mantienen las moléculas de sustrato en las posiciones
adecuadas. Algunos estudios han demostrado que la restricción de un movimiento
de dos elementos reactivos puede producir incrementos de velocidad de muchos órdenes
de magnitud.
El
segundo lugar, la formación de enlaces débiles entre enzima y sustrato también
da lugar a la de solvatación del
sustrato. Interacciones enzima-sustrato remplaza la mayoría de, o todos, los
enlaces de hidrógeno que pueden existir en disolución entre el sustrato y el
agua. En tercer lugar, la energía de fijación correspondiente a las
interacciones débiles formadas únicamente en el estado de transición de la reacción
ayuda a compensar determinadamente cualquier distorsión, principalmente en
formas de distribución electrónica, que debe experimentar el sustrato para
reaccionar. Finalmente, el propio enzima puede experimentar un cambio en la
conformación cuando se fija el sustrato, también inducido por múltiples
interacciones débiles con el sustrato. Esta situación se conoce como encaje inducido, un mecanismo postulado
por Daniel Koshland en 1958.
Los movimientos pueden afectar a una pequeña zona
del enzima cerca del sitio activo o aplicar cambios en la posición de dominios
enteros. Normalmente se genera una red de movimientos acoplados en todo el
enzima que da lugar a los cambios necesarios en el sitio activo. El encaje
inducido puede servir para disponer grupos funcionales específicos del enzima
en la orientación agrupada para catalizar la reacción. El cambio de
conformación también permite la formación de interacciones débiles adicionales
en el estado de transición. En cualquier caso, la nueva conformación del enzima
ha incrementado sus propiedades catalíticas. El encaje inducido es una
característica usual en la unión reversible de los ligandos a las proteínas. El
encaje inducido también es importante en la interacción de casi todos los
enzimas con sus sustratos.






